SK 독자개발 신약, 국내 최초 美FDA에 NDA 제출
SK 독자개발 신약, 국내 최초 美FDA에 NDA 제출
SK가 독자 개발한 뇌전증 신약이 세계 최대 바이오·제약 격전지인 미국 시장에 도전장을 내민다. 글로벌 투자형 지주회사 SK㈜의 자회사인 SK바이오팜은 뇌전증 신약 후보물질 세노바메이트(Cenobamate)의 신약 판매허가 신청서를 美FDA(식품의약국)에 제출했다.
국내 기업이 독자 개발한 혁신 신약을 기술 수출하지 않고 FDA에 NDA를 제출한 것은 이번이 최초다. 세노바메이트는 최고 수준의 기술과 전문성이 필요한 중추신경계 난치성 질환 치료제로 FDA 판매 허가를 받게 되면 2020년 상반기 내 미국 판매가 가능할 것으로 보인다.
SK바이오팜은 북미·유럽·아시아·중남미 등에서 2400여 명을 대상으로 진행한 임상시험 결과를 바탕으로 미국 법인인 SK라이프사이언스(SK Life Science, Inc.)를 통해 NDA를 제출했다. 부분발작(Partial onset seizure)을 보이는 뇌전증 환자들을 대상으로 다수의 기관에서 두 번에 걸쳐 위약 대조 임상 2상 효능 시험과 대규모 장기 임상 3상 안전성 시험 등을 진행했다.
뇌전증이란 뇌 특정 부위에 있는 신경 세포가 흥분해 발작이 반복적으로 나타나는 질환이다. 지금까지 많은 뇌전증 치료제가 시판됐지만 뇌전증 환자 가운데 절반 이상은 여전히 발작 증상으로 고통받고 있어 새로운 치료제에 대한 요구가 크다. 시장조사 기관인 글로벌 데이터(Global Data)에 따르면 전세계 뇌전증 치료제 시장은 2022년까지 69억 달러(약 7조 원) 규모로 2018년 대비 12% 성장할 전망이다.
SK바이오팜은 국내 최다인 16개 신약후보 물질의 임상 시험 승인(IND, Investigational New Drug)을 FDA로부터 확보했으며 작년 12월 美 Jazz社와 공동 개발한 수면장애 신약 솔리암페톨(Solriamfetol) 역시 FDA에 NDA를 제출한 상태다.
바이오·제약을 미래 신성장 동력으로 육성하고 있는 SK㈜는 SK바이오텍을 중심으로 한 원료의약품 생산 사업에도 투자를 지속하고 있다. 작년 SK바이오텍 아일랜드 공장 인수에 이어 지난 7월에는 美CDMO(위탁개발 및 생산업체) 앰팩(AMPAC) 인수에 성공했다. 세노바메이트의 시판이 결정되면 SK㈜ 자회사인 SK바이오텍 등이 원료의약품 생산에 나설 것으로 보인다.
SK의 독자개발 신약이 상업화에 성공하면 SK바이오팜은 연구, 임상 개발뿐 아니라 생산 및 판매까지 독자적으로 수행하는 '글로벌 종합제약사(FIPCO: Fully Integrated Pharma Company)'로 본격 도약할 뿐 아니라 한국의 글로벌 신약강국의 서막을 여는 획기적 이정표를 세우게 될 것으로 전망된다.

Articles
-
 빈혈이 있다면 커피 과다 섭취 자제해야
빈혈이 있다면 커피 과다 섭취 자제해야
-
 올해 교역액 사상 최대인 1조 1440억 달러로 세계 6위 전망
올해 교역액 사상 최대인 1조 1440억 달러로 세계 6위 전망
-
 2018 '가장 믿음직한 금융사' 국민은행·카드 삼성생명·화재 선정
2018 '가장 믿음직한 금융사' 국민은행·카드 삼성생명·화재 선정
-
 11월 수출, 사상 최초로 7개월 연속 500억 달러 돌파
11월 수출, 사상 최초로 7개월 연속 500억 달러 돌파
-
 환절기 면역력 높이는 식품, '마늘·김치·버섯·생강'
환절기 면역력 높이는 식품, '마늘·김치·버섯·생강'
-
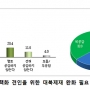 국민 64% '비핵화 견인 위해 대북제재 완화 필요'
국민 64% '비핵화 견인 위해 대북제재 완화 필요'
-
 신한류 애니메이션, 해외마켓서 수출액 1억 4천만 달러 달성!
신한류 애니메이션, 해외마켓서 수출액 1억 4천만 달러 달성!
-
 LG유플러스, 세계 최초 5G 상용화 서비스 개시
LG유플러스, 세계 최초 5G 상용화 서비스 개시
-
 누리호 시험로켓 발사 '현대중공업 기술이 뒷받침'
누리호 시험로켓 발사 '현대중공업 기술이 뒷받침'
- SK 독자개발 신약, 국내 최초 美FDA에 NDA 제출
-
 넥센타이어,폭스바겐에 신차용 타이어(OE) 공급
넥센타이어,폭스바겐에 신차용 타이어(OE) 공급
-
 현대 제네시스 G70, 미국 모터트렌드 '올해의 차' 선정
현대 제네시스 G70, 미국 모터트렌드 '올해의 차' 선정
-
 아시아나항공, 비행자료분석시스템 고도화 구축
아시아나항공, 비행자료분석시스템 고도화 구축
-
 쌍용자동차, 중남미시장에 렉스턴 스포츠 본격 론칭
쌍용자동차, 중남미시장에 렉스턴 스포츠 본격 론칭
- 한화, 이집트에 맞춤형 해안포 방어체계 솔루션 선보여
-
 서울시, 남녀공무원 형평위해 여성공무원 숙직 시행
서울시, 남녀공무원 형평위해 여성공무원 숙직 시행
-
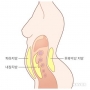 젊은 여성 10명 중 3명 마른 비만 상태
젊은 여성 10명 중 3명 마른 비만 상태
- 경북도, 바이오 메디푸드산업 클러스터 조성 잰걸음
- 서울시 '찾동' 골목, 더 강하고 촘촘해지는 찾동 2.0
- 전남도 무안국제공항 고공행진 사상 첫 50만 명 돌파
Designed by sketchbooks.co.kr / sketchbook5 board skin
Sketchbook5, 스케치북5
Sketchbook5, 스케치북5
Sketchbook5, 스케치북5
Sketchbook5, 스케치북5