지난해 국내 개발 신약 5개 품목 허가 ‘역대 최다’
지난해 국내 개발 신약 5개 품목 허가 ‘역대 최다’
지난해 식품의약품안전처가 허가한 국내 개발 신약은 5개로, 국내 개발 신약 허가 품목 수를 집계하기 시작한 1999년 이래로 최고치를 기록했다.
식약처의 ‘2021년 의약품 허가 보고서’에 따르면 지난해 신약 37개 품목을 허가했고 코로나19 백신은 6개를 허가했다.
한편 지난해 의약품 허가 신고된 품목은 총 2270개 품목으로 주요 특징은 ▲국내 개발 코로나19 치료제 첫 허가 ▲제네릭의약품 큰 폭 감소, ‘새로운 조성’ 의약품 절반 차지 ▲‘순환계용 의약품’이 약효군 중 1위로 증가세 ▲첨단바이오 의약품 전 주기 안전관리 체계 본격 가동 등이다.
제네릭의약품이란 신약 또는 국내에서 최초로 허가받은 원개발사 의약품과 주성분, 함량, 제형, 효능, 효과, 용법과 용량이 동일한 의약품으로서, 신약 또는 원개발사 의약품과 동등성이 인정된 의약품이다.
연도별 코로나19 치료제 백신 허가 현황(2020년~2021년)
‘2021년 의약품 허가 보고서’에 따르면 신약은 28개 성분의 37개 품목을 허가한 가운데 국내 개발 신약은 5개 허가로 역대 최고를 기록했다.
해당 신약은 레이저티닙(비소세포폐암), 레그단비맙(코로나19 항체치료제), 에플라페그라스팀(호중구감소증), 백부근등 한약추출물(급성기관지염), 펙수프라잔(역류성 식도질환)이다.
희귀 난치성 환자의 치료 기회 확대를 위한 희귀의약품은 19개 성분의 22개 품목을 허가해 전년 수준을 유지했다.
아울러 지난해 2월 ‘한국아스트라제네카백스제브리아주’를 코로나19 백신으로 국내 처음으로 허가한 이후 지난해 4개 성분의 6개 품목 백신을 허가했는데, 이 중 2개 품목은 국내 제조로 허가했다.
이와 함께 국내 의약품 제조업체가 개발한 코로나19 항체치료제 ‘렉키로나주960mg(레그단비맙)’을 처음으로 허가했다. 특히 이 품목은 전 세계에서 세 번째로 의약품 규제기관에서 안전성과 효과성을 검증한 코로나19 치료제이다.
한편 제네릭의약품의 허가 신고 품목 수는 전년 대비 약 41% 감소했는데, 동일한 임상 시험자료를 이용할 수 있는 품목 수를 3개로 제한하는 약사법 개정이 제네릭의약품 허가 신고 품목 수 감소에 영향을 미친 것으로 분석된다.
또한 허가한 280개 자료제출의약품 중 ‘새로운 조성’ 의약품은 137개로 전체의 절반 가까이 차지했다. 이 중 고지혈증 치료제가 80개로 고지혈증의 치료제 시장에서 제약업체 간의 경쟁이 매우 치열할 것으로 예상된다.
약효군별로 분류했을 때 ‘혈압강하제’ 등이 포함된 순환계용 의약품이 526개 품목으로 26.3%를 차지해 1위였다.
순환계용 의약품은 전년 581개 품목에 이어 1위를 차지한 것으로 전체에서 차지하는 비중은 7.6%p 증가했는데, 고령화 등 혈압약 시장의 지속적 확대에 따른 것으로 분석된다.
뒤이어 당뇨병용제 및 기타의 대사성 의약품 387개 품목, 신경계용 의약품 243개 품목, 소화기관용 의약품 171개 품목, 혈액 및 체액용약 168개 품목, 알레르기용약 38개 품목, 항생물질제제 20개 품목 순이었다.

Articles
-
 정치 바람에 흔들리는 '4 대강' 정책, 건설하고 열고 다시 가두고
정치 바람에 흔들리는 '4 대강' 정책, 건설하고 열고 다시 가두고
-
 윤석열 당선인, 취임 10일 남겨놓고 위기관리 능력 의심 받고 있어
윤석열 당선인, 취임 10일 남겨놓고 위기관리 능력 의심 받고 있어
-
 현대차 제네시스 GV70, 미국 ‘카앤드라이버’ 중소형 럭셔리 SUV 급 비교평가 1위
현대차 제네시스 GV70, 미국 ‘카앤드라이버’ 중소형 럭셔리 SUV 급 비교평가 1위
-
 LG생활건강, MZ세대 타겟 미국 ㈜The Creme Shop 인수
LG생활건강, MZ세대 타겟 미국 ㈜The Creme Shop 인수
-
 현대두산인프라코어, 터키 발전기 제조사와 엔진 2,400여대 계약
현대두산인프라코어, 터키 발전기 제조사와 엔진 2,400여대 계약
-
 두산에너빌리티, 美 뉴스케일파워와 SMR 제작 착수 협약
두산에너빌리티, 美 뉴스케일파워와 SMR 제작 착수 협약
-
 XM3 하이브리드, 1분기 유럽 수출 263% 급증
XM3 하이브리드, 1분기 유럽 수출 263% 급증
-
 한국 국민 소득, 2025년에 1인당 4만불 달성 전망
한국 국민 소득, 2025년에 1인당 4만불 달성 전망
-
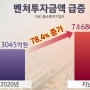 올해 1분기 벤처투자 첫 2조원 돌파로 '역대 최대'
올해 1분기 벤처투자 첫 2조원 돌파로 '역대 최대'
-
 3월 산업생산, 9개월 만에 최대 폭 1.5% 증가해
3월 산업생산, 9개월 만에 최대 폭 1.5% 증가해
-
 자궁근종, 미혼과 가임기 여성층에 증가해 '적극적 검진 필요'
자궁근종, 미혼과 가임기 여성층에 증가해 '적극적 검진 필요'
-
 위장약과 소화제, 증상에 따라 알맞게 복용해야
위장약과 소화제, 증상에 따라 알맞게 복용해야
-
 자외선 차단제 사용 시 주의사항
자외선 차단제 사용 시 주의사항
-
 지난해 국내 개발 신약 5개 품목 허가 ‘역대 최다’
지난해 국내 개발 신약 5개 품목 허가 ‘역대 최다’
-
 고용보험 가입자, 3개월 연속 전년비 50만명 이상 증가
고용보험 가입자, 3개월 연속 전년비 50만명 이상 증가
-
 한국 사회, 코로나19 장기화로 디지털 전환 급변
한국 사회, 코로나19 장기화로 디지털 전환 급변
-
 중국 1분기 경제성장률, 예상보다 낮은 4.8% 기록
중국 1분기 경제성장률, 예상보다 낮은 4.8% 기록
- 국내 코로나 재감염 추정사례 2만6239명로 '전체 0.284%'
-
 한국 마스크 착용 일부해제,'실외 밀집된 곳과 실내는 여전히 의무'
한국 마스크 착용 일부해제,'실외 밀집된 곳과 실내는 여전히 의무'
-
 국제선 하늘길, 전 분야 일상회복 본격화로 5월부턴 활짝
국제선 하늘길, 전 분야 일상회복 본격화로 5월부턴 활짝
Designed by sketchbooks.co.kr / sketchbook5 board skin
Sketchbook5, 스케치북5
Sketchbook5, 스케치북5
Sketchbook5, 스케치북5
Sketchbook5, 스케치북5