기업
삼성바이오로직스, FDA 첫 완제의약품 제조 승인 획득
by 편집부 posted Aug 13, 2018
삼성바이오로직스,
FDA 첫 완제의약품 제조 승인 획득
삼성바이오로직스가 미국 식품의약품 품질 안정성 인증기관인 FDA (Food and Drug Administration)로부터 첫 완제의약품 (DP: Drug Product)에 대한 제조 승인을 획득했다.
삼성바이오로직스는 앞서 유럽의약품청 (EMA)과 일본 의약품의료기기종합기구 (PMDA)로부터 이미 완제의약품 승인을 받은바 있어 바이오 의약품 3대 시장인 미국, 유럽, 일본에 완제의약품을 공급할 수 있게 됐다.
바이오의약품 제조는 크게 원료의약품(DS: Drug Substance)과 완제의약품두 가지가 있다. 원료의약품은 발효, 추출, 또는 이들의 조합에 의해 제조된 물질로서 완제의약품의 제조원료가 되며, 완제의약품은 제조된 원료의약품을 소형유리병(Vial)에 담는 과정이다.
완제의약품은 병입하는 과정에서 의약품이 필연적으로 외부공기에 노출되기 때문에 제조과정에 관리가 어렵고, 품질 인증 심사도 까다롭다. 이 때문에 많은 기업들이 인증 획득에 어려움을 겪고 있다.
하지만 삼성바이오로직스는 완제의약품까지 글로벌 인증 획득에 성공하며CMO로는 드물게 초기 개발단계의 세포주 개발부터 최종 단계인 완제의약품까지 End-to-End 서비스가 가능한 기업이 됐다.
삼성바이오로직스는 2015년말 첫 승인 이후, 2년반 만에 원료의약품 12건, 완제의약품 4건 등 제품기준 총 16건의 글로벌 인증을 획득했다.
바이오의약품 판매경쟁이 치열해짐에 따라 글로벌 제조승인을 단기간에 획득하여 조기에 출시하는 것이 매우 중요하다. 삼성바이오로직스는 효율적인 관리를 염두에 둔 공장 설계와 그 동안 축적된 품질관리 역량을 통해 품질 인증 기간을 1공장 26개월, 2공장 19개월로 대폭 줄였다.

삼성바이오로직스는 이러한 성과를 인정받아 지난 3월 미국의 전문지인 라이프 사이언스 紙와 '인더스트리 스탠더드 리서치 社'가 주관하는'CMO Leadership Award'에서 6개 핵심 역량 전 부문(품질, 역량, 안정성, 전문성, 호환성, 서비스)을 2년 연속 수상 한 바 있다.

Articles
-
 ‘핫 듀오’ 슈퍼주니어-D&E, 신곡에 남자 사랑고백 담아!
‘핫 듀오’ 슈퍼주니어-D&E, 신곡에 남자 사랑고백 담아!
-
 한류스타 강타, 뮤지컬 데뷔 첫 공연 성황
한류스타 강타, 뮤지컬 데뷔 첫 공연 성황
-
 ‘여름 지배자’ 레드벨벳, ‘Power Up’ 주간 음원과 음반 싹쓸이!
‘여름 지배자’ 레드벨벳, ‘Power Up’ 주간 음원과 음반 싹쓸이!
-
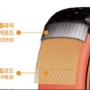 효성첨단소재㈜ 타이어코드, 아시아 판매 호조
효성첨단소재㈜ 타이어코드, 아시아 판매 호조
-
 넥센타이어, 英 프리미어 리그 맨체스터 시티 FC 후원 지속
넥센타이어, 英 프리미어 리그 맨체스터 시티 FC 후원 지속
-
 아시아나, 유니세프 동전 계수 봉사활동 펼쳐
아시아나, 유니세프 동전 계수 봉사활동 펼쳐
-
 삼성바이오로직스, FDA 첫 완제의약품 제조 승인 획득
삼성바이오로직스, FDA 첫 완제의약품 제조 승인 획득
-
 삼성전자, 전 세계 곳곳에 '갤럭시 노트9' 대형 옥외광고 진행
삼성전자, 전 세계 곳곳에 '갤럭시 노트9' 대형 옥외광고 진행
-
 KT, 530억 규모 필리핀 망구축사업 수주
KT, 530억 규모 필리핀 망구축사업 수주
-
 대한전선, 중동서 2550만달러 규모 초고압 프로젝트 수주
대한전선, 중동서 2550만달러 규모 초고압 프로젝트 수주
-
 '심(心)스틸러' 한국드라마 日안방극장 상륙
'심(心)스틸러' 한국드라마 日안방극장 상륙
-
 문 대통령, 여름 휴가 독서 서적 판매량 3-4배 증가
문 대통령, 여름 휴가 독서 서적 판매량 3-4배 증가
-
 한국인, 정부 부처 중 절반은 '일 못한다' 생각
한국인, 정부 부처 중 절반은 '일 못한다' 생각
-
 직장인10명 중 6명, 본인의 직업에 만족해
직장인10명 중 6명, 본인의 직업에 만족해
-
 삶의 질 높이는 생활 SOC 사업 7조원 투자
삶의 질 높이는 생활 SOC 사업 7조원 투자
-
 2030년 산업기술 변화의 키워드는 'AI와 남북경협'
2030년 산업기술 변화의 키워드는 'AI와 남북경협'
-
 올 3분기 수출 전년동기대비 3% 내외 상승 전망
올 3분기 수출 전년동기대비 3% 내외 상승 전망
-
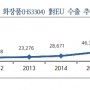 한국 화장품, 지난 8년간 유럽 수출 10 배 이상 확대되어
한국 화장품, 지난 8년간 유럽 수출 10 배 이상 확대되어
-
 한국 신재생에너지 생산량,높은 성장세 지속
한국 신재생에너지 생산량,높은 성장세 지속
-
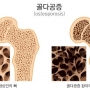 콩 기반 식품 많이 먹는 여성, 골다공증 예방에 도움 돼
콩 기반 식품 많이 먹는 여성, 골다공증 예방에 도움 돼
Designed by sketchbooks.co.kr / sketchbook5 board skin
Sketchbook5, 스케치북5
Sketchbook5, 스케치북5
Sketchbook5, 스케치북5
Sketchbook5, 스케치북5