댓글 쓰기 권한이 없습니다. 로그인 하시겠습니까?
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|

2009.12.16 03:26
유럽의약품청 인플루엔자 A(H1N1) 약품 안전성에 문제없어
조회 수 2500 추천 수 0 댓글 0
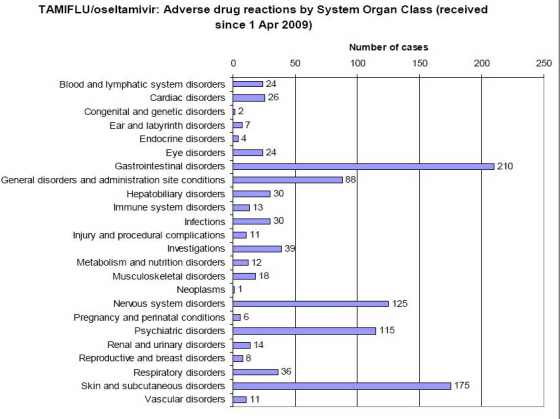 유럽 내 인플루엔자 A(H1N1) 관련 백신과 항바이러스제에 대해 접종 후 사망자가 다수 발생했지만 안전성에 특별한 문제가 없는 것으로 밝혀졌다. 유럽 내에서는 인플루엔자 A(H1N1) 관련 백신과 항바이러스제 접종후 지금까시 205 명 정도가 사망했으나, 이는 백신 등과는관계가 없는 것으로 발표되었다. 유럽의약품청이 12월 첫째주부터 조사한 결과 발표에 따르면 EU 차원에서 승인한 인플루엔자 A(H1N1) 백신 및 항바이러스제의 부작용 사례가??Focetria(Novartis사), Pandemrix(GSK사), Celvapan(Baxter사), Tamiflu(Roche사)가 주로 발생했으나,지금까지 예상하지 못한 인플루엔자 A(H1N1) 백신 및 항바이러스제 안전성 문제는 발견되지 않았다. 주로 보고된 부작용은 발열, 메스꺼움, 두통, 알러지, 주사 부위 반응과 같은 예상된 증상들이었다고 밝혔다. 다만, Pandemrix를 2차 접종받은 6~35개월 영아의 경우 발열 위험이 증가하는 것으로 확인되어 유럽의약품청 소속 인체용 의약품 위원회에서 이 사실을 처방 정보에 포함하여 2차 접종 후 영아의 체온을 모니터링하고 필요시 열을 떨어뜨리기 위한 조치를 취하도록 권고하였다고 유럽의약품청은 지난 4일 밝힌 적이 있었다. 지난 11월말 현재 Focetria는 EU 지역에서 약 450만회 접종된 것으로 추산되며, 5,228건의 부작용이 보고되었고, 접종자 중 12명이 사망하였으나, 백신이 사망 원인이라는 증거는 없었다. 뇌일혈 사례가 1건 발생하였고, 심한 과민성(anaphylactic) 반응이 3건 있었다. Pandemrix는 약 570만회 접종된 것으로 추산되며, 6,269건의 부작용이 보고되었고, 접종자 중 55명이 사망하였으나, 백신이 사망 원인이라는 징후는 없는 대신 유산, 자궁내 사망, 사산, 태아 운동기능 저하, 조산 등 임신 관련 사례 24건,과민성 반응을 보인 소아 사례가 26건등이 보고되었으며 자세한 조사가 진행중이나 현재로서는 백신과 보고된 사례간의 인과 관계는 없는 것으로 보인다고 밝혔다. Celvapan 접종량은 현재 추산하기 어려우며, 414건의 부작용이 보고되었고, 접종자 중 1명이 사망하였으나, 백신이 사망에 이르게 했다는 징후는 없었다. 한국에서 널리 사용되고 있는 Tamiflu는 2008년 10월부터 2009년 9월까지 1,040만명이 복용하였으며, 1,029건의 부작용이 보고되었고, Tamiflu 복용자 중 137명이 사망하였으나, 이는 기저 질환으로 인한 결과가 함께 보고된 것이며 Tamiflu 복용이 사망 원인이라는 것을 의미하지는 않았다. 유로저널 김 세호 기자 eurojournal01@eknews.net @유로저널 ONLY 뉴스 에 게재된 각국 기사 내용은 한국 언론들이나 포탈싸이트에 보도되지 않았거나, 본지가 직접 취재한 기사들만을 보도합니다. 
Designed by sketchbooks.co.kr / sketchbook5 board skin Sketchbook5, 스케치북5 Sketchbook5, 스케치북5 Sketchbook5, 스케치북5 Sketchbook5, 스케치북5 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

























 EU 무슬림들의 거주국 소속감, 英 가장 높아
EU 무슬림들의 거주국 소속감, 英 가장 높아