댓글 쓰기 권한이 없습니다. 로그인 하시겠습니까?
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
경제
2015.09.08 01:40
세계 바이오시밀러시장, 2015년부터 급성장해 연 60% 성장
조회 수 5197 추천 수 0 댓글 0
세계 바이오시밀러시장, 2015년부터 급성장해 연 60% 성장 바이오시밀러 시장이 2012년 이후 연평균 60%의 성장세가 전망되고 있다. 바이오시밀러랑 바이오신약의 복제약으로 합성의약품보다 효능이 뛰어나고 바이오신약보다 저렴한 약물을 말한다. 한국경제연구원(이하 한경연)은 2014년 전 세계 바이오시밀러 시장은 약 16억 6380만 달러 규모에 불과했지만, 2019년 240억 달러에 이를 것으로 보고서를 통해 분석했다. 한경연은 “2019년 세계 바이오시밀러 시장에서 유럽이 차지하는 비중이 45.8%에 달할 것으로 전망된다”며, 그 배경으로 의약품 품질관리에 방점을 둔 인허가제도를 선제적으로 도입한 점을 꼽았다. EU의 경우 세계 최초로 2005년 바이오시밀러 관련 규정을 제정하고 2006년 첫 제품을 승인했다. 그 결과, 전 세계 국가들이 EU 가이드라인을 기반으로 제도를 구축하면서 유럽이 세계 최대 시장을 형성하는 등 바이오시밀러 산업의 주도권을 선점했다. 반면 제약산업의 강자인 미국은 한 발 늦게 2010년 관련 법안을 도입해 EU의 제도를 참고한 가이드라인을 설계하고 있다. 또 EU는 바이오시밀러 의약품 명칭에 성분명을 넣도록 제도를 정비했다. 미국은 의사 처방 없이도 약국에서 바이오시밀러 약품에 대한 대체처방을 허용하는 방향으로 규정을 만들었다. 이에 반해 우리나라는 2009년 EU 가이드라인에 기반해 허가심사 규정을 제정하는 등 체계 구축에는 선제적이었으나, 아직 미국이나 EU수준으로 제도가 정비되어 있지 않다. 송용주 한경연 연구원은 “인허가제도만 정비해도 연구개발 단계부터 판매에 이르기까지 전 단계에 영향을 미쳐 품질보장이 가능하다”며, “브랜드 가치 향상과 수출 확대로 이어질 수 있을 것”이라고 설명했다. 특히 기존에 우리나라 제약산업은 내수중심으로 제품을 생산하다보니 인허가제도 수준이 까다로운 높은 미국과 EU에 수출이 어려운 실정이다. 한편 국내 의약품시장은 약가 규제로 규모가 협소하고 신약 개발에 대한 인센티브가 없으며, 중소업체가 많아 과당경쟁으로 수익을 내기도 어려워 글로벌 기업으로의 도약하는데 장애가 되고 있다고 보고서는 밝혔다. 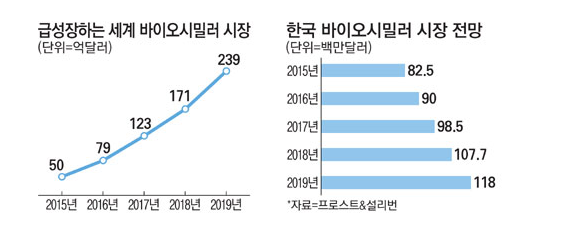
바이오시밀러는 원조 바이오의약품을 본떠 만든 복제약을 말한다. 일반 의약품은 특허 만료 후 화학적으로 복제해 원조약과 복제약 성분이 100% 똑같다. 반면 바이오의약품은 대장균, 효모, 동물세포 등 살아 있는 세포를 이용해 만든다. 그 복제약 역시 단백질처럼 살아 있는 세포의 생물학적 반응을 이용해 제조하기 때문에 원조약과 완전히 일치하지는 않는다. 그래서 유사하다는 의미의 '시밀러(similar)'라는 용어를 쓴다. 화학약품 복제약과 비교해 제조 과정이 까다롭고 별도 임상시험까지 거쳐야 하므로 비용과 시간도 더 많이 든다. 한국 유로저널 이준동 기자 eurojournal14@eknews.net 
Designed by sketchbooks.co.kr / sketchbook5 board skin Sketchbook5, 스케치북5 Sketchbook5, 스케치북5 Sketchbook5, 스케치북5 Sketchbook5, 스케치북5 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

























 8월 수출입 두자릿 수 비율 추락, 1 조달러 달성 어려울 듯
8월 수출입 두자릿 수 비율 추락, 1 조달러 달성 어려울 듯
 자영업자 가구 소득불균등 심화되고 임금근로자는 개선되어
자영업자 가구 소득불균등 심화되고 임금근로자는 개선되어